
SteQeyma®
Verfügbar für die i.v. – und s.c.-Applikation eignet sich dieses Ustekinumab-Biosimilar ab Therapiebeginn und für die langfristige Anwendung.*
* SteQeyma® ist erhältlich als 130 mg Infusionskonzentrat, 90 mg Injektionslösung in einer Fertigspritze und 45 mg Injektionslösung in einer Fertigspritze
Anwendung SteQeyma®

SteQeyma® ist als Konzentrat zur i.v.-Infusion und in einer vorgefüllten Spritze für die subkutane Injektion erhältlich. Nach umfassender Schulung eignet sich die vorgefüllte Spritze auch für die Selbstinjektion zuhause.
SteQeyma® ist für folgende Indikationen zugelassen*:
* SteQeyma® ist derzeit nicht für die Indikation Colitis ulcerosa zugelassen, da der Originalhersteller für diese Indikation noch die Exklusivität besitzt.
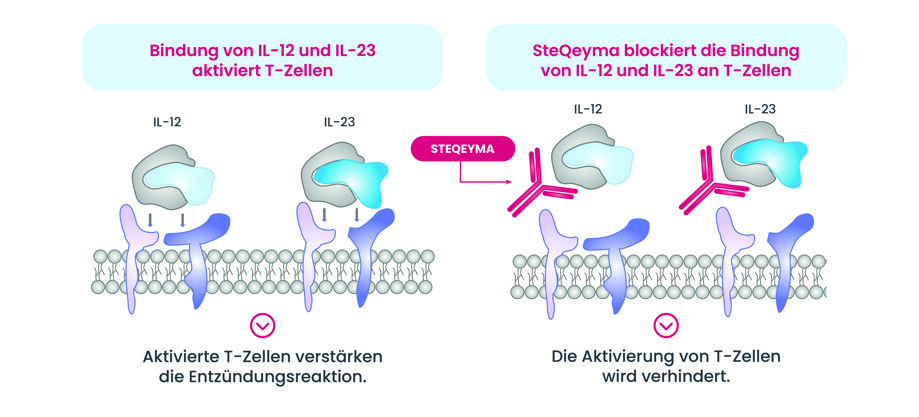
Wirkansatz

Bei dem Biologikum Ustekinumab handelt es sich um einen monoklonalen, humanen Antikörper mit entzündungshemmender Wirkung. Ustekinumab bindet an die pro-inflammatorischen Interleukine IL-12 und IL-23 und blockiert so deren Interaktion mit ihrem Zielrezeptor. Auf diese Weise wird die Entzündungsreaktion reduziert.
Durch seine Wirkung eignet sich Ustekinumab für die Behandlung diverser entzündlicher Erkrankungen, zum Beispiel von Plaque-Psoriasis - auch bei Kindern und Jugendlichen ab dem 6. Lebensjahr sowie von Psoriasis-Arthritis und Morbus Crohn.
Dosierschema

Morbus Crohn
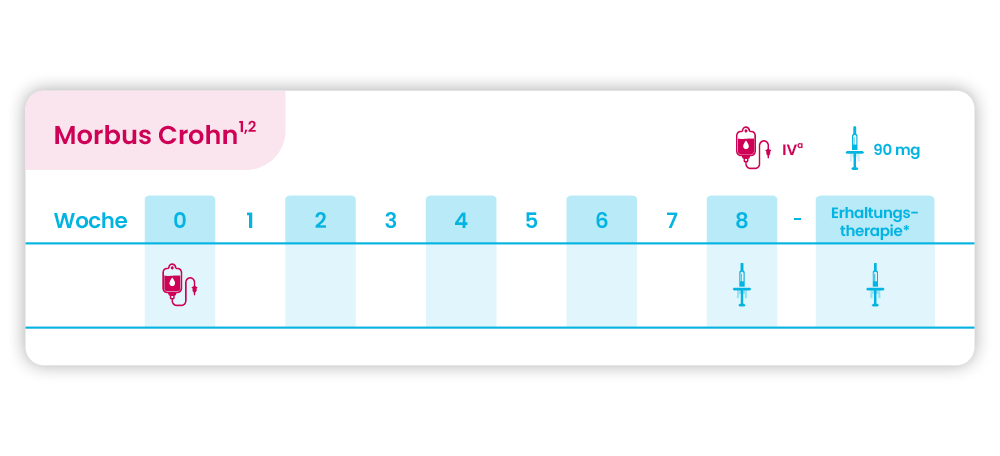
a. Bei geplanter Behandlung mittels SteQeyma®-Fertigspritze wird die erste Dosis SteQeyma® unter Anleitung und Aufsicht von medizinischem Personal intravenös verabreicht. Die empfohlene Dosis für Patienten mit einem Körpergewicht ≤ 55 kg beträgt 260 mg, für Patienten mit einem Körpergewicht > 55 kg bis ≤ 85 kg 390 mg und für Patienten mit einem Körpergewicht > 85 kg 520 mg.
* Erhaltungstherapie mit SteQeyma® 90 mg je nach klinischem Ermessen alle 8 oder 12 Wochen.
1. Aktuelle Fachinformation SteQeyma® 45 mg / 90 mg Injektionslösung in einer Fertigspritze.
2. Aktuelle Fachinformation SteQeyma® 130 mg Konzentrat zur Herstellung einer Infusionslösung.
Plaque-Psoriasis
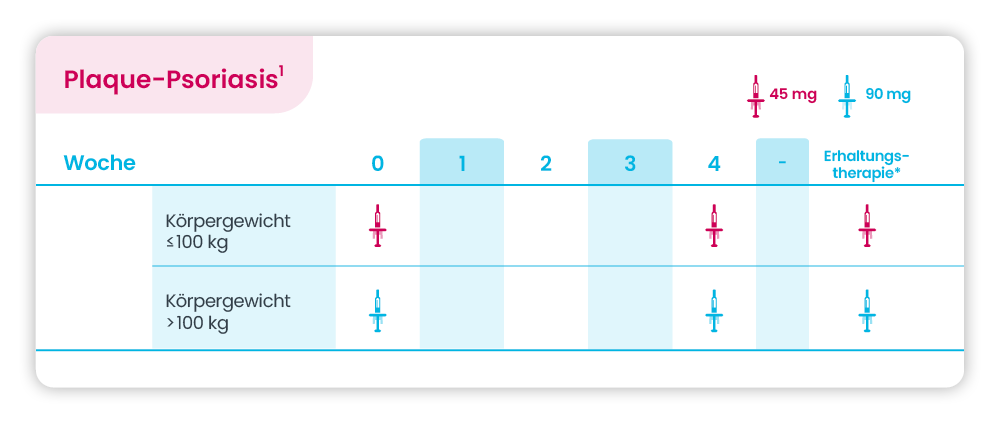
* Erhaltungstherapie alle 12 Wochen
1. Aktuelle Fachinformation SteQeyma® 45 mg / 90 mg Injektionslösung in einer Fertigspritze.
Plaque-Psoriasis bei Kindern und Jugendlichen ab 6 Jahren
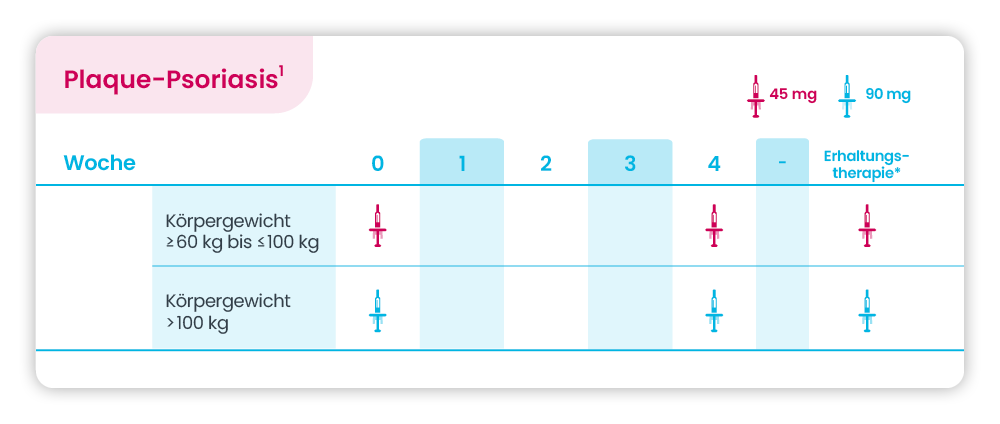
* Erhaltungstherapie alle 12 Wochen
1. Aktuelle Fachinformation SteQeyma® 45 mg / 90 mg Injektionslösung in einer Fertigspritze.
Psoriasis-Arthritis
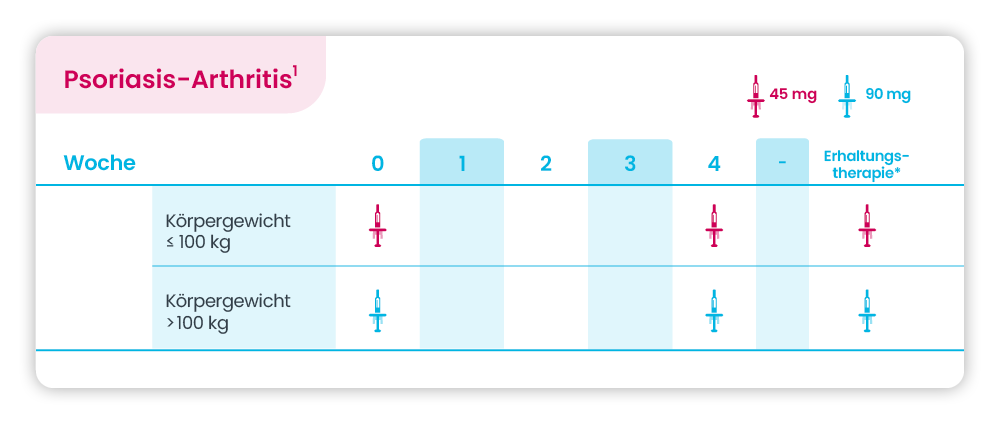
* Erhaltungstherapie alle 12 Wochen
1. Aktuelle Fachinformation SteQeyma® 45 mg / 90 mg Injektionslösung in einer Fertigspritze
Wichtige Dokumente

➔ Fachinformation für SteQeyma® 130 mg Konzentrat zur Herstellung einer Infusionslösung direkter Download
➔ Fachinformation für SteQeyma® 45 mg und SteQeyma® 90 mg in der Fertigspritze direkter Download
➔ Infusionsanleitung SteQeyma® direkter Download
➔ Infusionsprotokoll SteQeyma® direkter Download
➔ Materialanforderung SteQeyma® direkter Download

